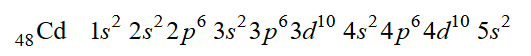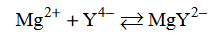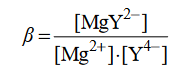wzory elektronowe typowych cząsteczek związków kowalencyjnych
Arkusz z chemii rozszerzonej marzec 2021
Jednym z produktów reakcji etanu z chlorem oraz produktem reakcji etenu z chlorowodorem jest ten sam związek organiczny.
Narysuj wzór elektronowy opisanego związku. Zaznacz kreskami wszystkie wspólne i wolne pary elektronowe.
wzór empiryczny i rzeczywisty związku chemicznego
Arkusz z chemii rozszerzonej marzec 2021
Do całkowitego spalenia próbki zawierającej 8,43·10²² cząsteczek pewnego węglowodoru zużyto 15,68 dm³ tlenu odmierzonego w warunkach normalnych. W reakcji wydzieliło się 18,48 g tlenku węgla(IV).
Ustal na podstawie obliczeń wzór sumaryczny tego węglowodoru.
wydajność reakcji estryfikacji
Arkusz z chemii rozszerzonej marzec 2021
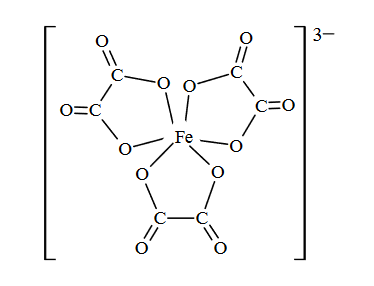
W temperaturze 25 °C do 1 mola kwasu etanowego dodano 1 mol etanolu i uzyskano mieszaninę o objętości V. Do otrzymanej mieszaniny dodano niewielką ilość stężonego kwasu siarkowego(VI). Przebiegła reakcja i w temperaturze 25 °C ustalił się stan równowagi, co zilustrowano równaniem:
Stężeniowa stała równowagi tej reakcji w temperaturze 25 °C jest równa Kc = 4.
Oblicz wydajność opisanej reakcji estryfikacji w temperaturze 25 °C.
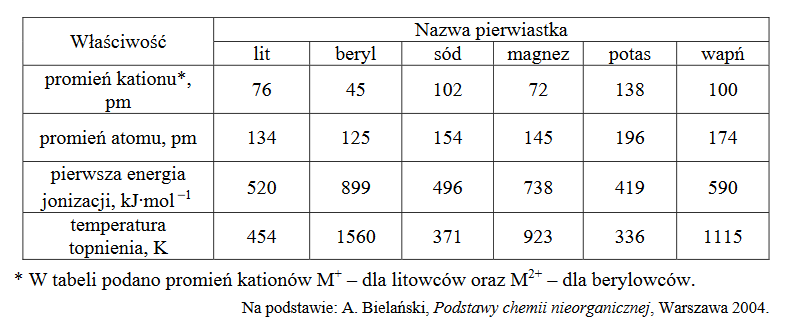
Atom pewnego pierwiastka
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Atom pewnego pierwiastka ma w stanie podstawowym niesparowany elektron walencyjny na podpowłoce p trzeciej powłoki.
Spośród wymienionych pierwiastków wybierz ten, którego dotyczy powyższy opis.
Zaznacz nazwę tego pierwiastka.
A. Sód.
B. Skand.
C. Miedź.
D. Chlor.
różne stany energetyczne atomów pierwiastków chemicznych
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Atomy pierwiastków chemicznych mogą występować w różnych stanach energetycznych. Stan o najniższej energii nazywamy podstawowym, a stany o energiach wyższych – wzbudzonymi.
Poniższe schematy I i II przedstawiają konfigurację elektronową dla orbitali walencyjnych atomu pewnego pierwiastka chemicznego X w różnych stanach energetycznych.

Uzupełnij poniższą tabelę – wpisz symbol pierwiastka X, numer grupy oraz symbol bloku konfiguracyjnego, do którego należy ten pierwiastek. Napisz, który schemat konfiguracji elektronowej (I albo II) opisuje stan podstawowy atomu pierwiastka X.

Stan podstawowy atomu pierwiastka X opisuje schemat numer ……..
energia potencjalna cząsteczek metanu
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Na poniższym wykresie przedstawiono, jak zmienia się energia potencjalna cząsteczek metanu w zależności od dzielącej je odległości (linia ciągła oznaczona numerem 1).
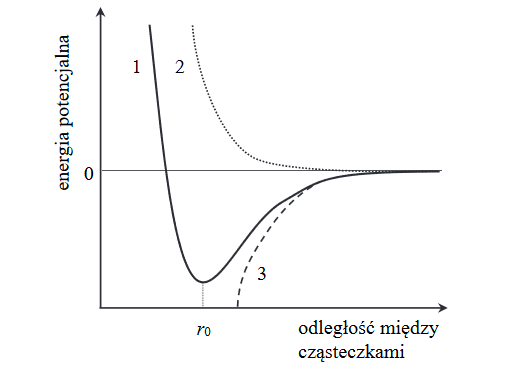
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
W miarę zbliżania się do siebie cząsteczek metanu siły przyciągania van der Waalsa rosną, co skutkuje spadkiem energii potencjalnej cząsteczek zilustrowanym krzywą oznaczoną numerem (2 / 3). Jednocześnie w miarę zbliżania się do siebie cząsteczek metanu siły odpychania między jądrami atomowymi i siły odpychania między elektronami dwóch cząsteczek (rosną / maleją). Najbardziej korzystny energetycznie dla cząsteczek metanu jest stan, w którym odległość między nimi jest (mniejsza niż r0 / równa r0 / większa od r0 ).
najbardziej znane odmiany alotropowe węgla – diament i grafit
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Diament i grafit to najbardziej znane odmiany alotropowe węgla.
Oceń, czy poniższe informacje dotyczące diamentu i grafitu są prawdziwe.
Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

budowa kowalencyjna związków chemicznych
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Jodowodór HI, metan CH4 i siarkowodór H2 S mają budowę kowalencyjną. Wszystkie te wodorki w warunkach normalnych są gazami.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

kąty pomiędzy wiązaniami tworzonymi przez atomy
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
Badania wykazały, że atomy tworzące wiązanie peptydowe stanowią sztywny i płaski element strukturalny. Mała odległość między atomem węgla a atomem azotu, które tworzą to wiązanie, wskazuje, że w znacznym stopniu ma ono charakter wiązania podwójnego (około 50%). W rezultacie kąty między wiązaniami tworzonymi przez opisane atomy są zbliżone do 120º. Wiązanie peptydowe może być opisane jako stan pośredni między dwiema strukturami zilustrowanymi poniżej na przykładzie fragmentu łańcucha peptydowego (R1 i R2 oznaczają łańcuchy boczne aminokwasów):
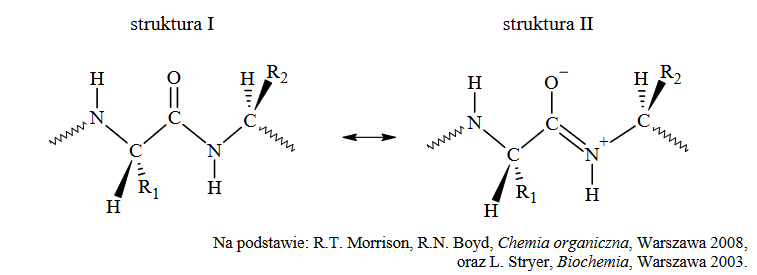
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

symbole chemiczne pierwiastków
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Wpisz do tabeli symbole chemiczne pierwiastków opisanych niżej.

Struktura atomu – jądro i elektrony
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Atomy pewnego pierwiastka oznaczonego umownie symbolem X mają w stanie podstawowym następującą konfigurację elektronową:
1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s² 4p⁵
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

różne stany energetyczne atomów pierwiastków chemicznych
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Atomy pierwiastków chemicznych mogą występować w różnych stanach energetycznych. Stan o najniższej energii nazywamy podstawowym, a stany o energiach wyższych – wzbudzonymi.
Atom germanu w stanie podstawowym ma dwa sparowane elektrony walencyjne w podpowłoce 4s i dwa niesparowane elektrony walencyjne w podpowłoce 4p.
Oceń, czy możliwe jest obsadzenie elektronami podpowłok 4s i 4p w atomie germanu w sposób przedstawiony poniżej. Odpowiedź uzasadnij.
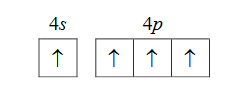
Ocena:
Uzasadnienie:
charakter wiązania chemicznego
Arkusz maturalny z chemii rozszerzonej kwiecień 2020 Formuła 2015
Cząsteczka trichlorku fosforu o wzorze PCl3 ma budowę przestrzenną podobną do struktury cząsteczki amoniaku.
1. Określ charakter wiązania chemicznego (wiązanie kowalencyjne niespolaryzowane, kowalencyjne spolaryzowane) w cząsteczce trichlorku fosforu i napisz wzór elektronowy tej cząsteczki. Zaznacz kreskami wiążące i wolne pary elektronowe.
Charakter wiązania:
Wzór elektronowy:
2. Uzupełnij poniższe zdania – wybierz i podkreśl jedno właściwe określenie spośród podanych w każdym nawiasie.
Orbitalom walencyjnym atomu centralnego w cząsteczce trichlorku fosforu przypisuje się hybrydyzację typu (sp / sp2 / sp3). Atom centralny (nie stanowi bieguna elektrycznego /
stanowi biegun elektryczny dodatni / stanowi biegun elektryczny ujemny) w tej cząsteczce.