Roztwory i reakcje zachodzące w roztworach wodnych
Arkusz z chemii rozszerzonej maj 2021
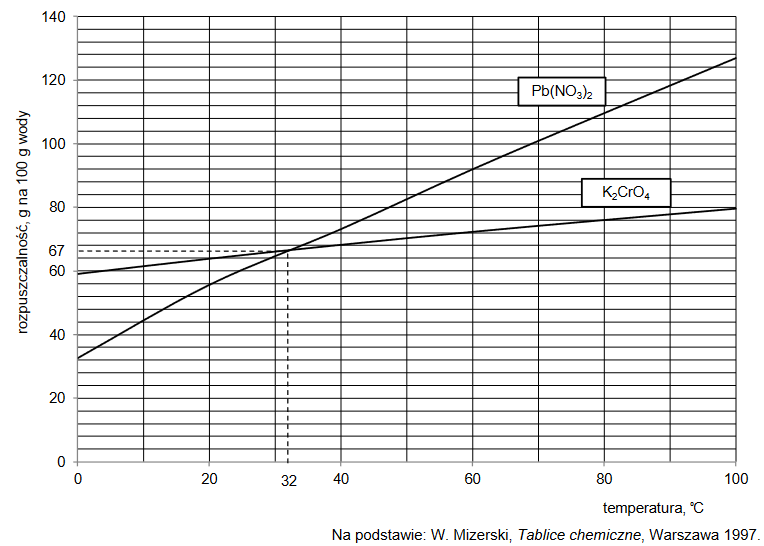
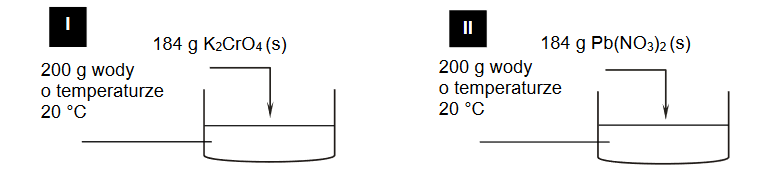
Do 20 cm3 wodnego roztworu HCl o pH = 1,0 dodano 30 cm³ wodnego roztworu NaOH o stężeniu 0,060 mol∙dm⁻³. Po zmieszaniu roztworów przebiegła reakcja chemiczna opisana
równaniem:
H3O⁺ + OH⁻ → 2H₂O
Wykonaj odpowiednie obliczenia i napisz, ile razy zmalało stężenie jonów hydroniowych H3O⁺ po dodaniu roztworu NaOH. Przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworów.
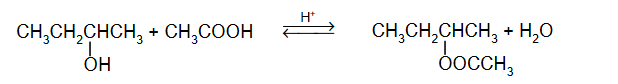
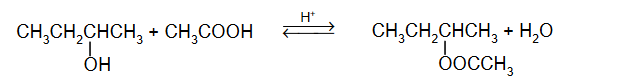
cząsteczki kwasu etanowego tworzące dimer
Arkusz z chemii rozszerzonej maj 2021
Cząsteczki kwasu etanowego mogą tworzyć dimer:
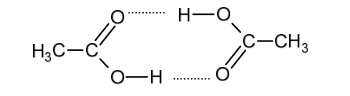
Dimer ten występuje w stanie gazowym oraz w roztworach kwasu etanowego w rozpuszczalnikach nietworzących z nim wiązań wodorowych.
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Przedstawiony w informacji dimer powstaje w wyniku tworzenia się wiązań (kowalencyjnych / jonowych / wodorowych) między cząsteczkami kwasu etanowego. Rozcieńczony roztwór
kwasu etanowego w wodzie (nie zawiera dimerów / zawiera dimery), ponieważ woda (nie tworzy wiązań wodorowych / tworzy wiązania wodorowe) z cząsteczkami kwasu etanowego.
tworzenie wzorów dipeptydów i tripeptydów
Arkusz z chemii rozszerzonej maj 2021
Próbkę pewnego tripeptydu o masie 43,4 mg poddano całkowitej hydrolizie w stężonym kwasie solnym. Po odparowaniu uzyskanego roztworu do sucha otrzymano mieszaninę związków jonowych o wzorach:
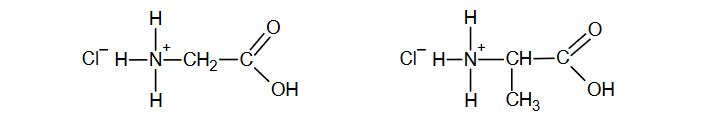
Uzyskaną w opisany sposób mieszaninę rozpuszczono w wodzie i dodano do niej nadmiar wodnego roztworu azotanu(V) srebra. Zaszła wtedy reakcja opisana równaniem: Ag⁺ + Cl⁻ → AgCl. Wytrącony osad AgCl odsączono, wysuszono i zważono. Jego masa była równa 86,1 mg.
Określ, z ilu reszt glicyny 𝒙 i z ilu reszt alaniny 𝒚 składała się jedna cząsteczka badanego tripeptydu. Napisz wzór tripeptydu w postaci Gly𝒙Ala𝒚. Przyjmij masę molową chlorku srebra MAgCl = 143,5 g ∙ mol ⁻¹.
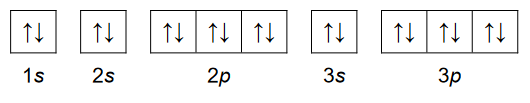
Struktura atomu – jądro i elektrony
Arkusz z chemii rozszerzonej marzec 2021
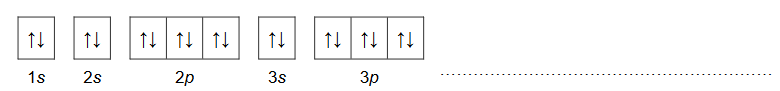
Konfigurację elektronową dwudodatniego kationu pierwiastka X przedstawia zapis: [Ar]3d¹⁰.
1. Uzupełnij poniższą tabelę. Wpisz symbol chemiczny pierwiastka X, numer grupy oraz symbol bloku konfiguracyjnego, do którego należy ten pierwiastek.

2 .Uzupełnij poniższy schemat. Przedstaw pełną konfigurację elektronową atomu (w stanie podstawowym) pierwiastka X. Zastosuj schemat klatkowy. W zapisie uwzględnij numery powłok i symbole podpowłok.
Pierwsza energia jonizacji – minimalna energia potrzebna do oderwania pierwszego elektronu od obojętnego atomu
Arkusz z chemii rozszerzonej marzec 2021
Pierwsza energia jonizacji (Ej 1) to minimalna energia potrzebna do oderwania pierwszego elektronu od obojętnego atomu. Każda następna energia jonizacji (Ej 2, Ej 3 itd.) to energia potrzebna do oderwania kolejnego elektronu od coraz bardziej dodatnio naładowanej drobiny. Wartości energii jonizacji zmieniają się okresowo w miarę wzrostu liczby atomowej. W tabeli podano wartość pierwszej energii jonizacji dla atomu wodoru i wartości kilku wybranych energii jonizacji dla atomów kolejnych pierwiastków pierwszej grupy układu okresowego.
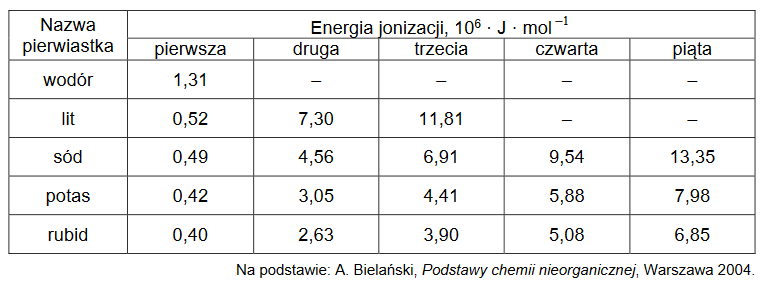
1. Wyjaśnij, dlaczego wartość pierwszej energii jonizacji atomu wodoru jest dużo większa niż wartość pierwszej energii jonizacji atomów kolejnych pierwiastków pierwszej grupy.
2. Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Pierwsza energia jonizacji litowca jest (mniejsza / większa) niż druga energia jonizacji, ponieważ:
• (łatwiej / trudniej) oderwać elektron od jonu naładowanego dodatnio niż od obojętnego atomu
oraz
• przyciąganie przez jądro elektronu z przedostatniej powłoki jest (silniejsze / słabsze) niż przyciąganie elektronu z powłoki ostatniej.
3. Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

Materiały i tworzywa pochodzenia naturalnego
Arkusz z chemii rozszerzonej marzec 2021
Siarczan(VI) sodu tworzy hydraty o różnym składzie. Próbkę jednego z hydratów tej soli, o masie 8,050 g, rozpuszczono w wodzie i otrzymano 100,0 cm³ roztworu, po czym dodano do niego 50,0 cm³ roztworu azotanu(V) baru o stężeniu 0,600 mol·dm⁻³. Wytrącony osad siarczanu(VI) baru po odsączeniu i wysuszeniu miał masę 5,825 g.
Ustal wzór hydratu siarczanu(VI) sodu użytego w opisanym doświadczeniu. Przyjmij, że opisane przemiany przebiegły z wydajnością równą 100%, a masy molowe są równe:
M Na₂SO₄ =142 g mol⁻¹
M BaSO₄ = 233 g mol⁻¹
energia wiązań chemicznych pomiędzy atomami węgla
Arkusz z chemii rozszerzonej marzec 2021
Poniżej przedstawiono wartości energii wiązań chemicznych pomiędzy atomami węgla oraz
długości tych wiązań w cząsteczkach etanu, etenu i etynu.
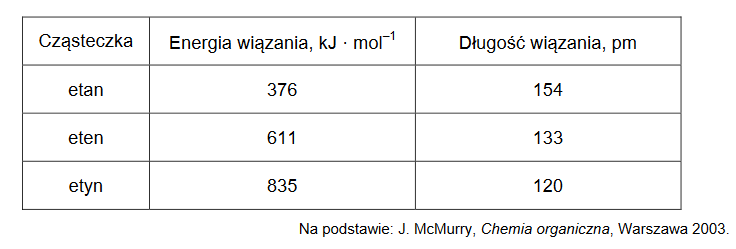
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
1. W cząsteczce etenu orbitalom walencyjnym atomów węgla przypisuje się hybrydyzację (sp3 / sp2). Podwójne wiązanie węgiel – węgiel w cząsteczce etenu powstaje w wyniku uwspólnienia (dwóch / czterech) elektronów.
2. Cząsteczki etynu są (liniowe / trygonalne).
3. Wraz ze wzrostem długości wiązania (rośnie / maleje) wartość energii niezbędnej do rozerwania wiązania.