Konfiguracje elektronowego pierwiastków.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Atomy pewnego pierwiastka oznaczonego umownie symbolem X mają w stanie podstawowym następującą konfigurację elektronową:
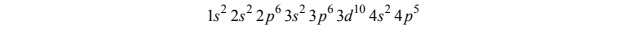

Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
Powłoki elektronowe atomu germanu.
Arkusz maturalny z chemii rozszerzonej 2018 nowa formuła
Atomy pierwiastków chemicznych mogą występować w różnych stanach energetycznych. Stan o najniższej energii nazywamy podstawowym, a stany o energiach wyższych – wzbudzonymi.
Na podstawie: W. Kołos, Elementy chemii kwantowej sposobem niematematycznym wyłożone, Warszawa 1984.
Atom germanu w stanie podstawowym ma dwa sparowane elektrony walencyjne
w podpowłoce 4s i dwa niesparowane elektrony walencyjne w podpowłoce 4p.
Oceń, czy możliwe jest obsadzenie elektronami podpowłok 4s i 4p w atomie germanu w sposób przedstawiony poniżej. Odpowiedź uzasadnij.

Zmiany elektroujemności w skali Paulinga pierwiastków.
Arkusz maturalny z chemii rozszerzonej czerwiec 2018 nowa formuła
Na poniższym diagramie przedstawiono zmiany elektroujemności w skali Paulinga
pierwiastków grup 1.–2. oraz 13.–17. układu okresowego (wartości elektroujemności
poszczególnych pierwiastków danej grupy połączono linią ciągłą)
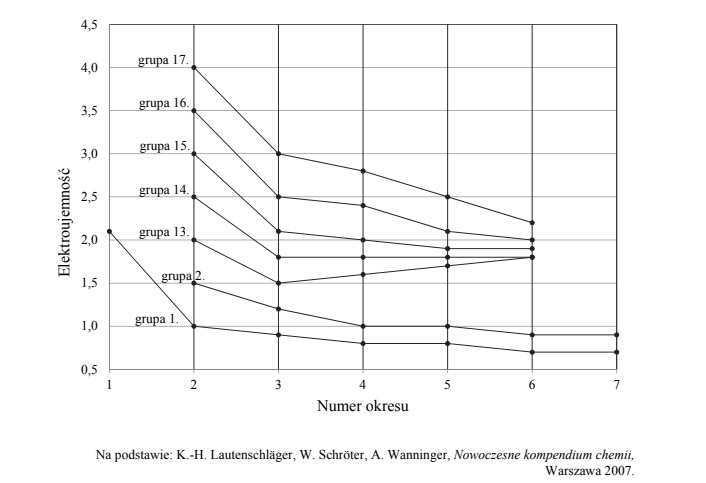

Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
Budowa cząsteczki trichlorku fosforu. Charakter wiązania.
Arkusz maturalny z chemii rozszerzonej czerwiec 2018 nowa formuła
Cząsteczka trichlorku fosforu o wzorze PCl3 ma budowę przestrzenną podobną do struktury cząsteczki amoniaku.
Określ charakter wiązania chemicznego (wiązanie kowalencyjne niespolaryzowane, kowalencyjne spolaryzowane) w cząsteczce trichlorku fosforu i napisz wzór elektronowy tej cząsteczki. Zaznacz kreskami wiążące i wolne pary elektronowe.

Uzupełnij poniższe zdania – wybierz i podkreśl jedno właściwe określenie spośród podanych w każdym nawiasie.
Orbitalom walencyjnym atomu centralnego w cząsteczce trichlorku fosforu przypisuje się
hybrydyzację typu (sp / sp2/ sp3). Atom centralny (nie stanowi bieguna elektrycznego /
stanowi biegun elektryczny dodatni / stanowi biegun elektryczny ujemny) w tej cząsteczce.
Pierwiastki X i Z leżą w czwartym okresie układu okresowego.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Pierwiastki X i Z leżą w czwartym okresie układu okresowego. Pierwiastek X jest metalem,
natomiast pierwiastek Z – niemetalem. W stanie podstawowym atomów obu tych pierwiastków
tylko jeden elektron jest niesparowany. Znajduje się on na ostatniej powłoce. Niesparowany
elektron atomu pierwiastka X znajduje się na innej podpowłoce niż niesparowany elektron
atomu pierwiastka Z. Ponadto wiadomo, że pierwiastek X tworzy tlenki o wzorach X2O i XO
oraz że ten metal jest jednym z najlepszych przewodników ciepła i elektryczności. Pierwiastek
Z występuje w postaci dwuatomowych cząsteczek.
Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, dane dotyczące ich
położenia w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy
każdy z pierwiastków.

Przedstaw konfigurację elektronową jonu X2+ (stan podstawowy). Zastosuj skrócony
zapis konfiguracji elektronowej z symbolem gazu szlachetnego.
Dla cząsteczki Z2 określ liczbę: wiązań σ, wiązań π oraz wolnych par elektronowych.
Jądra atomowe niektórych izotopów ciężkich pierwiastków bombardowane neutronami ulegająrozszczepieniu…
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Jądra atomowe niektórych izotopów ciężkich pierwiastków bombardowane neutronami ulegają
rozszczepieniu, czyli rozpadowi na mniejsze fragmenty. Jedną z możliwych reakcji
rozszczepienia jądra 235 U przedstawia poniższy schemat.
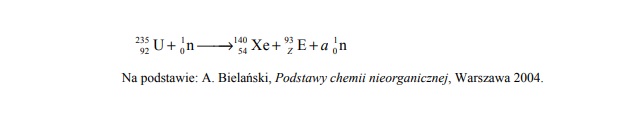
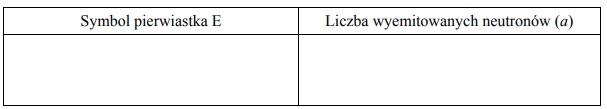
Uzupełnij poniższą tabelę. Na podstawie informacji wstępnej wpisz symbol pierwiastka E
oraz liczbę neutronów (a), wyemitowanych podczas przedstawionej reakcji rozszczepienia
jednego jądra
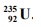
W poniżej tabeli przedstawiono wartości kolejnych (trzech) energii jonizacji glinu.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Elektrony w atomach są przyciągane przez jądro, więc usunięcie elektronu z powłoki wymaga
nakładu energii, która jest nazywana energią jonizacji. Pierwsza energia jonizacji to minimalna
energia potrzebna do oderwania pierwszego elektronu od atomu. Druga energia jonizacji jest
minimalną energią potrzebną do usunięcia drugiego elektronu (z jednododatniego jonu).
W odpowiednich warunkach od atomu można oderwać kolejne elektrony. Rozróżnia się zatem
pierwszą, drugą i kolejne energie jonizacji.
W poniżej tabeli przedstawiono wartości kolejnych (trzech) energii jonizacji glinu.

Uzupełnij poniższe zdanie, tak aby powstała informacja prawdziwa, i wyjaśnij, dlaczego
wybrana energia jonizacji ma najniższą wartość.
Spośród podanych wartości energii jonizacji najniższą wartość ma
(pierwsza / druga / trzecia) energia jonizacji, ponieważ
Promień atomu, kationu i anionu.
Arkusz maturalny z chemii rozszerzonej 2018 maj stara formuła
Na podstawie położenia w układzie okresowym następujących pierwiastków: Na, K, Cs,
Mg ustal i napisz symbol tego, który:
• ma największy promień jonowy (promień kationu)
• wykazuje największą aktywność chemiczną
• tworzy tlenek o najsłabszych właściwościach zasadowych.
Konfiguracja elektronowa kationu żelaza.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Konfiguracja elektronów w pewnym kationie żelaza w stanie podstawowym jest następująca:
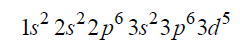

Napisz wzór opisanego kationu żelaza oraz przedstaw graficznie konfigurację elektronów trzeciej powłoki w tym kationie w stanie podstawowym.
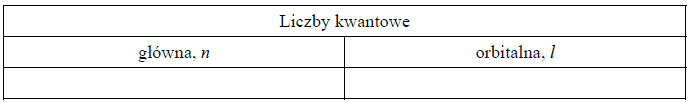
Liczby kwantowe elektronów walencyjnych.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Elektrony walencyjne w atomach (w stanie podstawowym) pewnego pierwiastka, którego symbol oznaczono umownie literą X, mają następującą konfigurację:
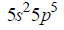
1. Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

2. Uzupełnij poniższą tabelę – wpisz wartości dwóch liczb kwantowych opisujących niesparowany elektron w atomie pierwiastka X.
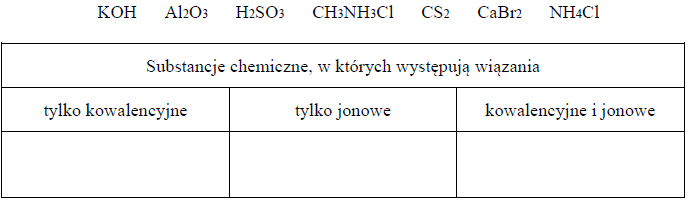
Rodzaje wiązań chemicznych w cząsteczkach
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Uzupełnij poniższą tabelę. Wpisz wzory substancji chemicznych do odpowiednich kolumn. Substancje wybierz spośród następujących:
Określanie promienia jonowego jonu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
W tabeli zapisano informacje dotyczące promieni atomowych i jonowych.

Rozstrzygnij, która z nich jest prawdziwa. Zaznacz P przy zdaniu prawdziwym.
Struktura elektronowa kwasu azotowego (V)
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Poniżej przedstawiono jeden ze wzorów opisujących strukturę elektronową HNO3.
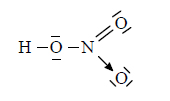
Ustal liczbę wiązań typu σ i π oraz liczbę niewiążących par elektronowych występujących w cząsteczce kwasu azotowego(V) o przedstawionej powyżej strukturze.
Różnica wartości kąta pomiędzy podstawnikami w metanie, amoniaku i wodzie.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
W cząsteczkach CH4, NH3 i H2O występuje ten sam typ hybrydyzacji orbitali walencyjnych atomu centralnego, ale w każdej z tych cząsteczek wartość kąta pomiędzy wiązaniami jest inna. Wynosi ona około 109° w cząsteczce CH4, około 107° w cząsteczce NH3 i około 105° w cząsteczce H2O.
Określ typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu centralnego w cząsteczkach CH4, NH3 i H2O oraz napisz, co jest przyczyną różnicy wartości kąta pomiędzy wiązaniami w tych cząsteczkach.
Konfiguracja elektronów kationu żelaza.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 nowa formuła
Napisz wzór opisanego kationu żelaza oraz przedstaw graficznie konfigurację elektronów trzeciej powłoki w tym kationie w stanie podstawowym.
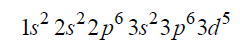

Napisz wzór opisanego kationu żelaza oraz przedstaw graficznie konfigurację elektronów trzeciej powłoki w tym kationie w stanie podstawowym.