Wpływ katalizatora na szybkość reakcji rozkładu nadtlenku wodoru.
Arkusz maturalny z chemii podstawowej maj 2017
Wróć do listyEnergia aktywacji określa wielkość bariery energetycznej, którą muszą pokonać reagujące
drobiny, aby doszło do reakcji chemicznej. Im mniejsza jest energia aktywacji dla danej
reakcji, tym szybciej zachodzi przemiana. Dużą energię aktywacji reakcji można zmniejszyć,
jeżeli wprowadzi się do układu katalizator.
Nadtlenek wodoru ulega reakcji rozkładu według równania:
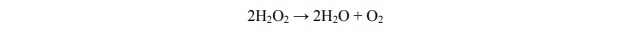
W temperaturze pokojowej szybkość rozkładu H2O2 jest mała. W poniższej tabeli podano
wartości energii aktywacji reakcji rozkładu H2O2 bez udziału katalizatora oraz z udziałem
różnych katalizatorów.

Oceń, którego katalizatora spośród wymienionych w informacji należy użyć, aby
reakcja rozkładu nadtlenku wodoru w temperaturze T przebiegła z największą
szybkością. Napisz nazwę tego katalizatora.
KOREPETYCJE