Zadanie 105.
2015 zbiór CKE
Wróć do listyŻelazo jest pierwiastkiem chemicznym, którego atomy występują w przyrodzie w postaci 4 trwałych odmian izotopowych. Najbardziej rozpowszechnioną odmianę stanowią nuklidy o liczbie masowej 56. Silnie rozdrobnione żelazo zapala się samorzutnie w powietrzu. Produktem utleniania żelaza w wysokich temperaturach jest magnetyt,
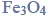
Powstaje on także w czasie spalania żelaza w czystym tlenie (reakcja 1.). Oprócz tlenku
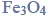
żelazo tworzy jeszcze 2 inne tlenki:
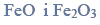
W podwyższonych temperaturach żelazo reaguje również z parą wodną według równania:
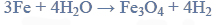
(reakcja 2.), natomiast działając gazowym chlorem na żelazo w podwyższonej temperaturze, uzyskuje się chlorek żelaza(III) (reakcja 3.). Pary chlorku żelaza(III) kondensują, tworząc ciemnobrunatne kryształy dobrze rozpuszczalne w wodzie. Żelazo ma zdolność zastępowania mniej aktywnych metali w ich roztworach. Przebiega wtedy reakcja opisana schematem:
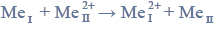
Powyższa przemiana zachodzi także podczas doświadczenia zilustrowanego rysunkiem:
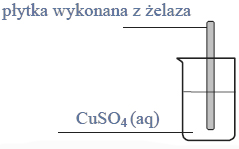
Na podst.: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004, s. 917–934; M. Sienko, R. Plane, Chemia, podstawy i zastosowania, Warszawa 1996, s. 542–550; J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002, s. 202.
Substancję, którą otrzymano w wyniku reakcji 3., rozpuszczono w wodzie i zbadano odczyn wodnego roztworu tej substancji.
a) Określ odczyn wodnego roztworu opisanej substancji i potwierdź go odpowiednim równaniem reakcji zapisanym w formie jonowej skróconej.
b) Napisz wzory związków chemicznych i jonów obecnych w wodnym roztworze tej substancji.
KOREPETYCJE