reakcje zachodzące w roztworach wodnych
Arkusz z chemii rozszerzonej czerwiec 2021
Wróć do listyPrzeprowadzono doświadczenie, podczas którego do kolby zawierającej 100 cm3 wodnego roztworu jednoprotonowego kwasu HA dodawano porcjami wodny roztwór wodorotlenku sodu o stężeniu 0,1 mol · dm−3 i mierzono pH mieszaniny reakcyjnej. Podczas doświadczenia zachodziła reakcja opisana schematem:
HA + NaOH → NaA + H2O
Doświadczenie prowadzono w temperaturze 25 °C. Jego przebieg zilustrowano poniższym wykresem, zwanym krzywą miareczkowania.
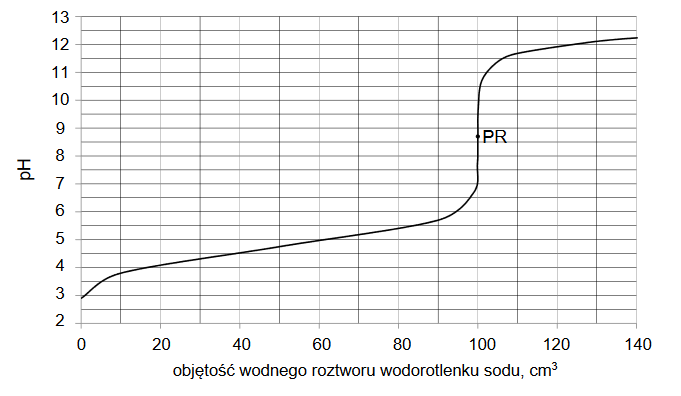
Po dodaniu takiej objętości roztworu wodorotlenku sodu, w jakiej znajdowała się liczba moli NaOH równa liczbie moli kwasu HA w roztworze wziętym do analizy, w układzie został osiągnięty punkt równoważnikowy (PR). W opisanym doświadczeniu pH w punkcie równoważnikowym było równe 8,6.
1. Po wykonaniu doświadczenia sformułowano następujący wniosek:
Na podstawie otrzymanych wyników można jednoznacznie stwierdzić, że kwas HA nie jest mocnym elektrolitem.
Rozstrzygnij, czy powyższy wniosek jest prawdziwy. Uzasadnij swoją odpowiedź – napisz w formie jonowej skróconej równanie reakcji ilustrujące równowagę, która ustaliła się w punkcie równoważnikowym. Użyj ogólnego wzoru kwasu HA.
Rozstrzygnięcie:
Równanie reakcji ilustrujące stan równowagi:
2. Krzywa miareczkowania może służyć do wyznaczenia wartości stałej dysocjacji kwasu (Ka), a przez to pozwala zidentyfikować kwas poddawany miareczkowaniu. Jedna z metod polega na wyznaczeniu tak zwanego punktu połowicznego zmiareczkowania (PP), w którym stężenie HA jest równe stężeniu A − . Stała równowagi dysocjacji kwasu HA opisana jest wyrażeniem:
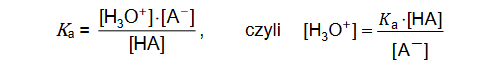
Stężenie HA jest równe stężeniu A − po dodaniu połowy objętości roztworu NaOH potrzebnej do osiągnięcia punktu równoważnikowego (PR). Wtedy:
[H3O + ] =Ka, czyli
pH = –log [H3O + ] = –logKa = pKa
Tak więc w punkcie połowicznego zmiareczkowania pH jest równe –logKa.
2.1 Odczytaj z wykresu krzywej miareczkowania i napisz wartość pH w punkcie połowicznego zmiareczkowania (PP). Który z wymienionych poniżej kwasów mógł być użyty w opisanym doświadczeniu? Wybierz i zaznacz jego wzór.
Wartość pH w punkcie połowicznego zmiareczkowania:
Wzór kwasu:
HClO CH3COOH HClO2
2.2 Oceń prawdziwość poniższych zdań. Zaznacz P, jeżeli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.


KOREPETYCJE