Odwracalny proces autodysocjacji wody ciężkiej
INFORMATOR o egzaminie maturalnym z chemii 22/23
Wróć do listyWoda ciężka (tlenek deuteru, D2O), której cząsteczki zawierają deuter – izotop wodoru ²H, podobnie jak zwykła woda, ulega odwracalnemu procesowi autodysocjacji opisanemu równaniem:
2D2O ⇄ D3O+ + OD−.
Proces autodysocjacji można opisać stałą dysocjacji K D₂O zależną od temperatury.
Wygodnym sposobem posługiwania się stałą dysocjacji jest wyrażenie jej wartości w formie zlogarytmowanej: pK D O2 = − logK D₂O .
Zestawienie wartości pK D₂O w różnych temperaturach podano w tabeli.
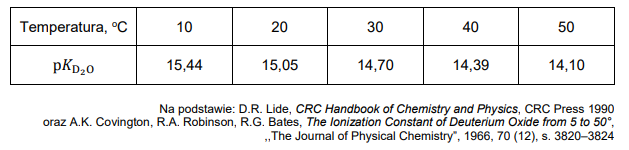
Wartość pK H₂O (pKw) dla procesu autodysocjacji wody zwykłej w temperaturze 25°C wynosi 14,00.
Narysuj wykres zależności p𝐾𝐾D2O od temperatury i oblicz stężenie molowe jonów OD⁻ w ciężkiej wodzie w temperaturze 25°C. Rozstrzygnij, który proces dysocjacji – D₂O czy H₂O – zachodzi w większym stopniu w temperaturze 25°C.
Obliczenia:

KOREPETYCJE