Wartość ph w punkcie równoważnikowym kwasów HA i HB
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 stara formuła
Wróć do listyPrzygotowano wodne roztwory jednoprotonowych kwasów HA i HB. Przeprowadzono doświadczenie, podczas którego do próbek tych kwasów o objętości 100 cm3, znajdujących się w oddzielnych naczyniach, dodawano porcjami wodny roztwór wodorotlenku sodu o stężeniu 0,1 mol · dm–3 i za pomocą pehametru mierzono pH każdej mieszaniny reakcyjnej. Przebieg doświadczeń zilustrowano poniższym wykresem.
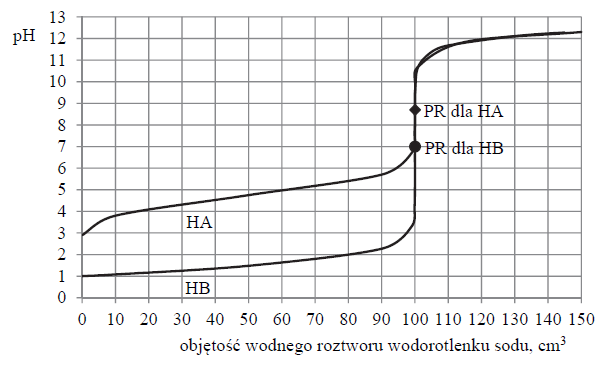
Na wykresie dla obu substancji zaznaczono punkt równoważnikowy (PR), czyli wartość pH roztworu po dodaniu stechiometrycznej ilości wodnego roztworu NaOH.
W celu określenia punktu równoważnikowego można przeprowadzić analogiczne
doświadczenia, stosując wskaźniki kwasowo-zasadowe, czyli związki chemiczne, które
przyjmują różne zabarwienia w roztworach o różnych odczynach. Wizualne metody
wyznaczania PR miareczkowania z zastosowaniem wskaźników polegają na dodawaniu – do roztworu miareczkowanego – takiego wskaźnika, który zmieni barwę w punkcie
równoważnikowym reakcji. Dla każdego wskaźnika jest określony zakres pH, w którym
następuje zmiana jego zabarwienia. Poniżej scharakteryzowano cztery wskaźniki kwasowo- -zasadowe.
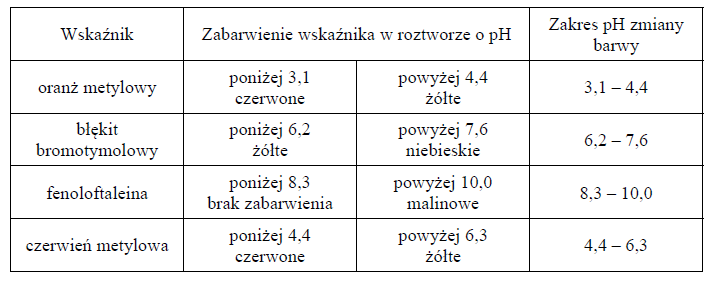
Poprawnie dobrany wskaźnik użyty w procesie miareczkowania to taki, którego obszar zmiany barwy, spowodowanej dodaniem niewielkiej ilości roztworu miareczkującego, znajduje się wewnątrz skoku miareczkowania (na praktycznie pionowym odcinku wykresu miareczkowania) i leży możliwie najbliżej punktu równoważnikowego.
Na podstawie: J. Minczewski, Z. Marczenko: Chemia analityczna. Podstawy teoretyczne i analiza jakościowa, Warszawa 2001.
Spośród scharakteryzowanych wskaźników wybierz i podkreśl nazwy wszystkich tych, których można użyć do wyznaczenia PR w doświadczeniach z kwasami HA i HB.
1. Wskaźnikiem, który najlepiej spełnia opisane kryteria doboru wskaźnika kwasowozasadowego dla kwasu HA, jest:
oranż metylowy
błękit bromotymolowy
fenoloftaleina
czerwień metylowa
2. Zgodnie z opisanymi kryteriami doboru wskaźnika kwasowo-zasadowego można dla kwasu HB zastosować:
oranż metylowy
błękit bromotymolowy
fenoloftaleinę
czerwień metylową
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, lub F – jeśli jest fałszywa.

Wartość pH w punkcie równoważnikowym dla kwasu HA wynosi 8,70.
Stosując definicje kwasu i zasady Brønsteda, napisz w formie jonowej skróconej (używając ogólnego wzoru kwasu HA) równanie reakcji uzasadniające pH roztworu w punkcie równoważnikowym.
KOREPETYCJE