Oblicz pH roztworu wodorosiarczanu(VI) sodu
Arkusz maturalny z chemii rozszerzonej maj 2018 nowa formuła
Wróć do listyKwas siarkowy(VI) w temperaturze pokojowej jest oleistą cieczą o gęstości prawie dwukrotnie większej niż gęstość wody. Czysty, bezwodny kwas siarkowy(VI) ulega częściowej autodysocjacji, dzięki czemu przewodzi prąd elektryczny. W wyniku reakcji kwasu siarkowego(VI) z wodorotlenkiem sodu, w której stosunek molowy
substratów jest równy 1 : 1, powstaje wodorosiarczan(VI) sodu. Wodny roztwór wodorosiarczanu(VI) sodu charakteryzuje się kwasowym odczynem, ponieważ jony obecne w roztworze ulegają reakcji zgodnie z poniższym równaniem:
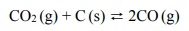
Stała równowagi opisanej reakcji w temperaturze T jest równa 1,0 · 10 −2 .
Na podstawie: T. Mizerski, Tablice chemiczne, Warszawa 2004
Napisz równanie autodysocjacji kwasu siarkowego(VI) polegającej na przeniesieniu protonu z jednej cząsteczki H2SO4 do drugiej. W równaniu podkreśl wzór kwasu Brønsteda sprzężonego z cząsteczką H2SO4 jako zasadą Brønsteda.
Rozpuszczono 0,600 g NaHSO4 w wodzie i otrzymano 100 cm3
roztworu o temperaturze T. W tym roztworze reakcji z wodą uległo znacznie więcej niż 5% jonów
wodorosiarczanowych(VI).
Oblicz pH tego roztworu. Wynik końcowy podaj z dokładnością do trzeciego miejsca po przecinku.

KOREPETYCJE