Zadanie 42.
2015 zbiór CKE
Wróć do listyReakcja syntezy amoniaku przebiega zgodnie z równaniem:

Na położenie stanu równowagi tej reakcji wpływ mają temperatura i ciśnienie.
W poniższej tabeli przedstawiono równowagowe zawartości amoniaku (w procentach objętościowych) w stechiometrycznej mieszaninie azotu i wodoru pod różnym ciśnieniem i w różnych temperaturach.
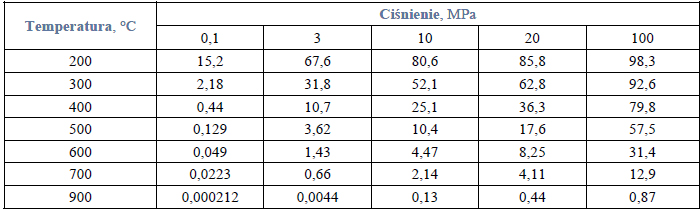
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004, s. 649.
Zależność wiążąca wszystkie parametry określające stan gazowy materii, czyli podająca zależność pomiędzy ciśnieniem (p), objętością (V), temperaturą (T) oraz liczbą moli gazu (n) zwana jest równaniem stanu gazu doskonałego lub równaniem Clapeyrona. Równanie ma postać:
p · V = n · R · T
R oznacza uniwersalną stałą gazową. Wartość R odczytaną z zestawu Wybranych wzorów i stałych fizykochemicznych na egzamin maturalny z biologii, chemii i fizyki można używać w równaniu Clapeyrona, jeżeli p wyrażone jest w paskalach, V w metrach sześciennych, n w molach i T w kelwinach.
Oblicz, ile moli amoniaku znajduje się w 2 m3 mieszaniny reakcyjnej w temperaturze 300°C i pod ciśnieniem 10 MPa (10*7 Pa) po ustaleniu stanu równowagi.
KOREPETYCJE