Analiza ilościowa, określenie stężenia jonów cynku.
Zbiór zadań maturalnych z chemii CKE 2015
Wróć do listySiarkowodór otrzymywany jest w laboratorium w reakcji kwasu solnego z siarczkiem żelaza(II). Reakcja ta przebiega zgodnie z równaniem:
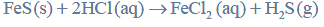
Tak otrzymany gazowy siarkowodór wykorzystuje się w analizie chemicznej do wytrącania osadów trudno rozpuszczalnych siarczków, np. siarczku cynku. Gdy wodny roztwór, w którym znajdują się jony cynku, nasyca się siarkowodorem, zachodzi reakcja opisana równaniem:
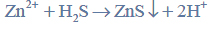
Po zakończeniu reakcji biały osad siarczku cynku odsącza się na sączku z bibuły, przemywa i umieszcza wraz z sączkiem w uprzednio zważonym porcelanowym tyglu. Następnie spala się sączek i praży osad w temperaturze 900 ºC aż do uzyskania stałej masy. Podczas prażenia osad siarczku cynku przechodzi w tlenek cynku zgodnie z równaniem:
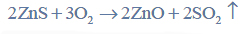
Znając masę otrzymanego tlenku cynku, można obliczyć masę cynku, który znajdował się w badanym roztworze.
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Chemiczne metody analizy ilościowej, t. 2, Warszawa 1998, s. 174–175.
Aby wyznaczyć stężenie jonów cynku w badanym wodnym roztworze rozpuszczalnej soli cynku, pobrano próbkę tego roztworu o objętości 50 cm3 i umieszczono ją w zlewce. Pobrany roztwór rozcieńczono i ogrzano, a następnie pod wyciągiem nasycano siarkowodorem. Po upływie godziny od zakończenia reakcji wytrącony osad odsączono, przemyto i włożono do tygla, w którym był prażony do stałej masy. Otrzymano 243 mg tlenku cynku.
Oblicz stężenie molowe jonów cynku w badanym roztworze.
KOREPETYCJE