Parowy reforming metanu.
Arkusz maturalny z chemii rozszerzonej czerwiec 2017 stara formuła
Wróć do listyW procesie parowego reformingu metanu (konwersji metanu z parą wodną) w pierwszym etapie ten gaz reaguje z parą wodną w obecności katalizatora niklowego – w temperaturze około 1070 K i pod ciśnieniem około
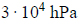
zgodnie z równaniem:
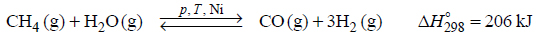
Pomimo że stechiometryczny stosunek molowy substratów reakcji jest równy 1, ten proces prowadzi się przy nadmiarze pary wodnej.
Na podstawie: K. Schmidt-Szałowski, M. Szafran, E. Bobryk, J. Sentek, Technologia chemiczna. Przemysł nieorganiczny, Warszawa 2013.
1. Określ, czy wzrost temperatury wpływa na zwiększenie wydajności opisanej reakcji konwersji, jeżeli zachodzi ona pod stałym ciśnieniem p, oraz czy wzrost ciśnienia skutkuje wzrostem wydajności tej reakcji. Odpowiedź uzasadnij.
2. Szybkość opisanej reakcji wzrasta ze wzrostem ciśnienia.
Poniżej zestawiono warunki, w jakich przeprowadza się opisany proces parowego reformingu metanu:

Dokończ poniższe zdania – wpisz numery wszystkich warunków prowadzenia procesu, które wpływają na szybkość i wydajność konwersji metanu.
1. Warunki sprzyjające dużej szybkości reakcji: …………………………………………………………….
2. Warunki sprzyjające dużej wydajności reakcji: …………………………………………………………
3. Oblicz, ile m3 wodoru w przeliczeniu na warunki normalne powstało w pierwszym etapie parowego reformingu metanu prowadzonego w temperaturze 1070 K i pod ciśnieniem
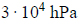
jeżeli wykorzystano 1 m3 metanu odmierzony w warunkach przemiany oraz nadmiar pary wodnej. Wydajność przemiany metanu była równa 95%.
KOREPETYCJE