Zadanie 24.
2017 czerwiec SR
Wróć do listyW zamkniętym naczyniu pomiędzy substancjami X, Y oraz Z, które w temperaturze T i pod ciśnieniem p są gazami, ustala się stan równowagi chemicznej.
Zmianę liczby moli reagentów X, Y oraz Z w trakcie procesu przedstawia poniższy wykres.
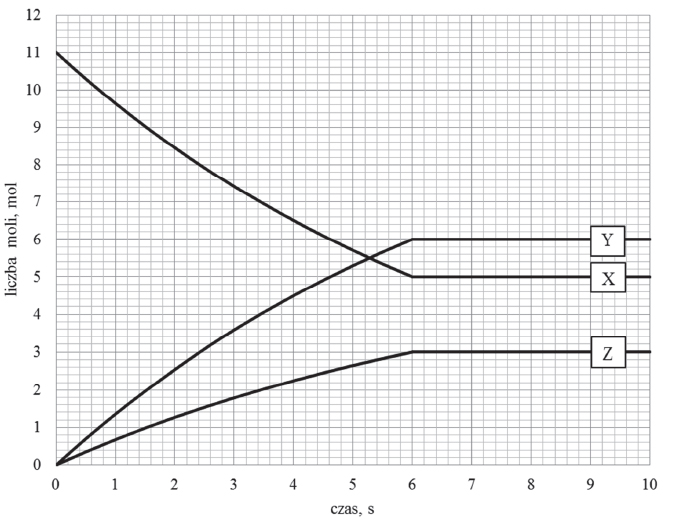
Podczas reakcji, dla której zmianę liczby moli reagentów przedstawiono na wykresie, wydziela się ciepło. Naczynie reakcyjne, w którym został osiągnięty stan równowagi, podgrzano do temperatury T1 wyższej od temperatury T.
Poniżej przedstawiono opinię dotyczącą szybkości reakcji chemicznych w stanie równowagi dynamicznej w temperaturze T1 oraz wartości Kc 1 w tej temperaturze.
„Po podgrzaniu układu do temperatury T1 ustala się nowy stan równowagi dynamicznej. Wartość Kc 1 w tej temperaturze jest większa od wartości Kc w temperaturze T. W stanie równowagi dynamicznej w wyższej temperaturze następuje wzrost szybkości reakcji przekształcenia substratu w produkty oraz spadek szybkości reakcji odwrotnej (w porównaniu do analogicznych wartości szybkości reakcji w stanie równowagi opisanych wartością Kc)”.
Oceń, czy informacja jest poprawna. Podkreśl właściwe określenie w każdym nawiasie i uzasadnij swoją ocenę. Informacja (jest / nie jest) poprawna. 2. W stanie równowagi układu w temperaturze T1 szybkość reakcji przekształcania substratu X w produkty jest (większa / mniejsza) niż w temperaturze T. W temperaturze T1 szybkość reakcji odwrotnej jest (większa / mniejsza) niż w temperaturze T.
1. Wartość Kc 1 w temperaturze T1 jest (większa / mniejsza) od wartości Kc w temperaturze T.
Uzasadnienie:
Uzasadnienie:
KOREPETYCJE