Elektroliza roztworu chlorowodoru.
Arkusz maturalny z chemii rozszerzonej maj 2019 stara formuła
Wróć do listyElektroliza wodnego roztworu HCl przebiega zgodnie z równaniem:
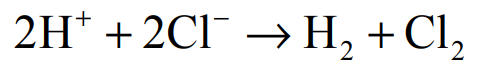
Podczas elektrolizy przez wodny roztwór HCl o objętości 400,0 cm3
i o stężeniu 0,1 mol·dm−3 przepłynął ładunek 3821,4 C.
Wykonaj odpowiednie obliczenia i określ, jak się zmieniło (wzrosło czy zmalało), i o ile jednostek, pH tego roztworu w wyniku elektrolizy. Podczas rozwiązywania zadania nie zaokrąglaj wyników pośrednich. Stała Faradaya ma wartość F = 96500 C · mol–1. Przyjmij, że objętość roztworu nie uległa zmianie, a podczas elektrolizy nie zachodziły procesy uboczne, np. rozkład wody.
KOREPETYCJE