Reakcje magnezu z kwasami
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Wróć do listyW dwóch probówkach oznaczonych numerami I i II umieszczono jednakową ilość wiórków magnezowych o tym samym stopniu rozdrobnienia. Następnie do probówek wprowadzono jednakowe objętości roztworów o tej samej temperaturze:
• do probówki I – kwas solny o pH = 1
• do probówki II – wodny roztwór kwasu siarkowego(VI) o stężeniu 0,1 mol * dm–3.
Przebieg doświadczenia zilustrowano poniższym rysunkiem.
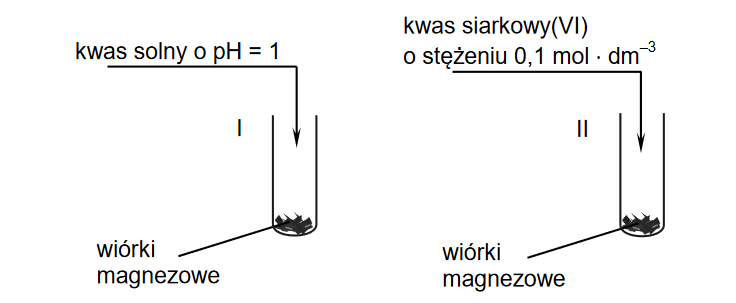
Podczas opisanego doświadczenia w każdej probówce wiórki magnezowe uległy całkowitemu roztworzeniu i powstały klarowne, bezbarwne roztwory, ale w jednej z probówek reakcja przebiegła szybciej.
1. Napisz w formie jonowej skróconej równanie reakcji, która zaszła podczas opisanego doświadczenia w obu probówkach. Wskaż numer probówki (I albo II), w której wiórki magnezowe roztworzyły się szybciej.
Równanie reakcji:
Wiórki magnezowe roztworzyły się szybciej w probówce numer
2. Uzupełnij poniższe zdanie – wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Stężenie molowe roztworów obu kwasów było (równe / różne), a stężenie jonów H+ w tych roztworach było (równe / różne), dlatego opisane doświadczenie pozwoliło określić wpływ (stężenia molowego / pH) roztworów użytych kwasów na szybkość reakcji.
3. Którą czynność należy wykonać w celu wyodrębnienia z mieszaniny poreakcyjnej jonowego produktu otrzymanego w probówce I? Zaznacz właściwą odpowiedź spośród podanych.
A. sączenie
B. dekantacja
C. odwirowanie
D. odparowanie pod wyciągiem

KOREPETYCJE