półogniwa standardowe – niklowe oraz srebrowe
MATERIAŁY DODATKOWE CKE 2022 - ELEKTROCHEMIA
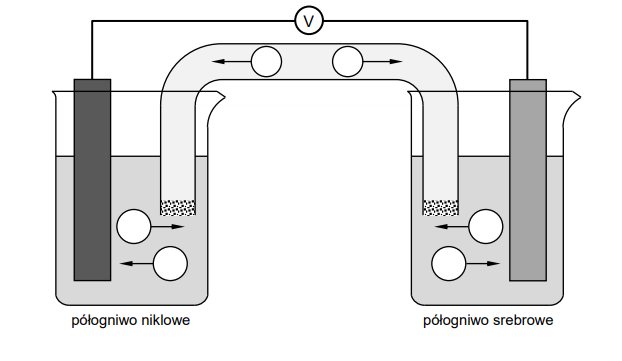
Wróć do listyPrzygotowano dwa półogniwa standardowe: niklowe oraz srebrowe. Do pierwszej zlewki wprowadzono 100 cm³ roztworu NiSO4 o stężeniu 1,00 mol·dm⁻³ i włożono blaszkę niklową
o masie 20,0 g. Do drugiej zlewki wprowadzono roztwór AgNO3 o stężeniu 1,00 mol·dm⁻³ i włożono blaszkę srebrną o masie 20,0 g. Roztwory wodne znajdujące się w zlewkach połączono kluczem elektrolitycznym (rurką szklaną zawierającą wodny roztwór azotanu(V) potasu KNO₃), którego zadaniem jest umożliwienie przepływu odpowiednich jonów pomiędzy roztworami elektrolitów tak, aby reguła elektroobojętności każdego z roztworów w zlewkach została spełniona. Blaszki wykonane z niklu i srebra (elektrody) połączono odpowiednimi przewodami zewnętrznymi poprzez woltometr.
1. Zapisz schemat przedstawionego ogniwa zgodnie z konwencją sztokholmską. Zapisz równania reakcji przebiegających na katodzie oraz sumaryczne równanie (w formie jonowej skróconej) zachodzącej w ogniwie.
Schemat ogniwa: (–) (+)
Równanie reakcji przebiegającej na anodzie:
Równanie reakcji przebiegającej na katodzie:
Sumaryczne równanie reakcji zachodzącej w ogniwie:
2. Uzupełnij poniższy rysunek, przedstawiający opisane ogniwo niklowo-srebrowe. W wyznaczone miejsca wpisz wzory jonów w taki sposób, żeby strzałki wskazywały kierunek, w jakim poszczególne jony, znajdujące się w roztworach w zlewkach oraz w kluczu elektrolitycznym, poruszają się w trakcie pracy ogniwa. Wzory jonów wybierz z poniższych:
Ni²⁺ • Ag⁺ • K⁺ • SO4²⁻ • NO₃
3. Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.

4. Oblicz, jaki ładunek elektryczny, wyrażony w kulombach, musi przepłynąć przez zewnętrzny obwód przedstawionego ogniwa niklowo-srebrowego, aby ogniwo uległo całkowitemu rozładowaniu. Oblicz masy obu płytek metalicznych po całkowitym rozładowaniu ogniwa.

KOREPETYCJE