Zadanie 3.
2006 czerwiec
Wróć do listy„(…) Energia potrzebna do oderwania najsłabiej związanego elektronu od izolowanego atomu w stanie gazowym nosi nazwę energii jonizacji. Energię tę wyznacza się spektroskopowo i wyraża się w kJ·mol-1. Ponieważ od większości atomów można oderwać jeden, dwa, trzy… elektrony, mówi się o pierwszej drugiej, trzeciej… energii jonizacji. (…)”
J. D. Lee: Zwięzła Chemia Nieorganiczna, Wydawnictwo Naukowe PWN Warszawa 1999, wydanie piąte, s. 105.
W poniższej tabeli przedstawiono wartości pierwszej energii jonizacji atomów wybranych
metali 1. grupy układu okresowego pierwiastków.
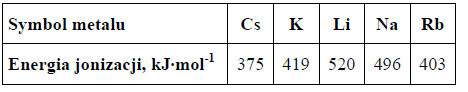
Na podstawie danych zawartych w tabeli określ, jak zmieniają się wartości energii jonizacji w podanej grupie układu okresowego wraz ze wzrostem liczby atomowej pierwiastków. Podaj jedną przyczynę takiej zależności.
KOREPETYCJE