Zadanie 24.
2015 zbiór CKE
Wróć do listyPoniżej przedstawiono konfigurację elektronową atomów w stanie podstawowym wybranych metali należących do 1. grupy układu okresowego pierwiastków. Metale te oznaczono numerami I, II i III.
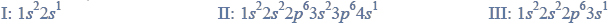
Pierwsza energia jonizacji to energia, jaką należy dostarczyć, aby oderwać elektron od obojętnego atomu
a) Zaznacz poprawne dokończenie zdania.
Najmniejszą pierwszą energię jonizacji ma atom pierwiastka oznaczonego numerem
A. I, ponieważ jego elektron walencyjny jest najmniej oddalony od jądra atomowego.
B. I, ponieważ ma obsadzone elektronami tylko dwie powłoki elektronowe.
C. II, ponieważ jego elektron walencyjny jest najbardziej oddalony od jądra atomowego.
D. III, ponieważ ma najmniejszą elektroujemność.
b) Określ liczbę elektronów w rdzeniu atomu metalu oznaczonego numerem III.
c) Napisz wzór sumaryczny związku metalu oznaczonego numerem II z chlorem i określ charakter wiązania chemicznego (jonowe, kowalencyjne niespolaryzowane, kowalencyjne spolaryzowane), które w tym związku występuje.
KOREPETYCJE