obliczenia z uwzględnieniem mola
Arkusz z chemii rozszerzonej maj 2021
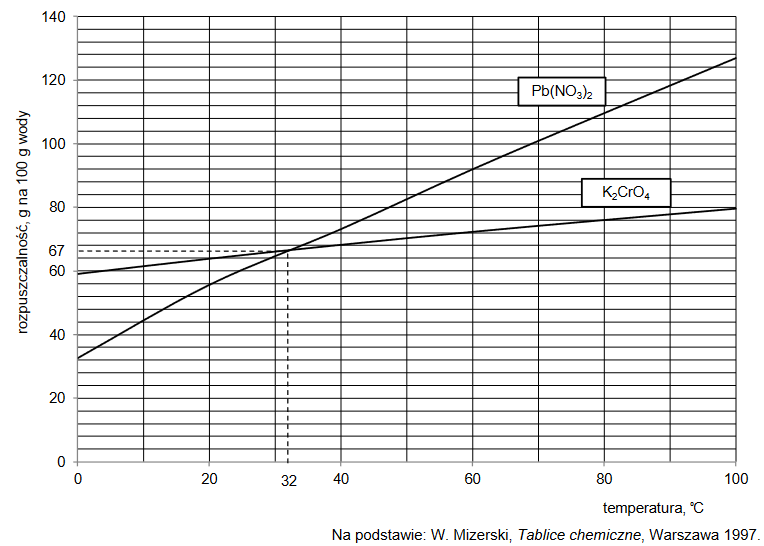
Wróć do listyNa wykresie przedstawiono zależność rozpuszczalności w wodzie dwóch soli – K₂CrO₄ i Pb(NO₃)₂ – od temperatury.
1. Przeprowadzono doświadczenie zilustrowane na poniższym schemacie.
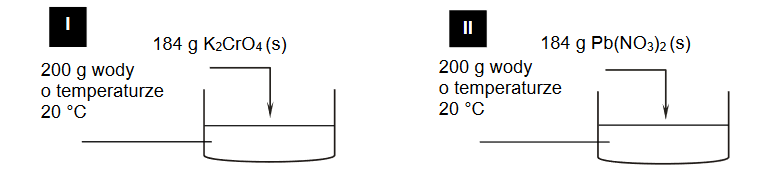
Napisz wartość temperatury 𝒕, a następnie uzupełnij poniższe zdanie dotyczące mieszanin otrzymanych w obu zlewkach po ogrzaniu ich zawartości do temperatury 𝒕. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
𝑡 =
Roztwór w zlewce I jest (nienasycony / nasycony), a jego stężenie wyrażone w procentach masowych jest (mniejsze niż / takie samo jak / większe niż) stężenie roztworu wyrażone w procentach masowych w zlewce II.
2. Do 100 gramów nasyconego roztworu azotanu(V) ołowiu(II) o temperaturze 32 °C dodano 100 gramów nasyconego roztworu chromianu(VI) potasu o temperaturze 32 °C. W wyniku
przemiany zilustrowanej poniższym równaniem wytrącił się osad.
Pb²⁺ + CrO₄²⁻ → PbCrO₄
Oblicz masę otrzymanego osadu. Wskaż substancję użytą w nadmiarze – podaj jej wzór lub nazwę. Przyjmij, że opisana przemiana przebiegła z wydajnością równą 100%.
Masy molowe są równe:
𝑴K₂CrO₄= 194 g∙mol⁻¹,
𝑴Pb(NO₃)2 = 331 g∙mol⁻¹,
𝑴PbCrO₄ = 323 g∙mol⁻¹.
Obliczenia:
Masa osadu:
W nadmiarze użyto:

KOREPETYCJE