miareczkowanie reduktometryczne – badanie Jakości gleb
INFORMATOR o egzaminie maturalnym z chemii 22/23
Wróć do listyJakość gleb zależy m.in. od zawartości tzw. próchnicy, stanowiącej mieszaninę związków chemicznych pochodzących z rozkładu szczątków organicznych. Sposób określenia w przybliżeniu zawartości próchnicy w glebie polega na ilościowym utlenieniu związków organicznych, których głównym składnikiem jest węgiel.
Utlenianie węgla zawartego w związkach organicznych można przeprowadzić za pomocą dichromianu(VI) potasu, w środowisku kwasu siarkowego(VI) z dodatkiem siarczanu(VI) rtęci(II) jako katalizatora (reakcja 1.), co w uproszczeniu można zilustrować równaniem:
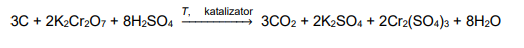
W tej metodzie stosuje się nadmiar dichromianu(VI), a następnie – w obecności wskaźnika – utleniacz dodany w nadmiarze poddaje się reakcji z jonami żelaza Fe²⁺ jako reduktorem (reakcja 2.).
6Fe²⁺+ + Cr2O7²⁻ + 14H⁺ → 6Fe³⁺ + 2Cr³⁺ + 7H2O
Jest to tzw. miareczkowanie reduktometryczne, podczas którego roztwór soli żelaza(II) o znanym stężeniu znajduje się w biurecie. Ten roztwór dodaje się stopniowo do kolby z utleniaczem i na końcu dokładnie odczytuje, jaka jego objętość została zużyta w reakcji.
1. W celu ustalenia zawartości próchnicy pobrano próbkę gleby o masie 450 mg. Do próbki dodano roztwór dichromianu(VI) potasu o stężeniu 0,10 mol ∙ dm⁻³, tak aby nadmiar utleniacza stanowił 15% przy założeniu, że zawartość próchnicy w glebie jest maksymalna (tabela 1.), a średnia zawartość węgla w próchnicy wynosi 58% (w procentach masowych). Na reakcję z nadmiarem utleniacza zużyto 42,6 cm³ roztworu reduktora (jony Fe²⁺) o stężeniu 0,10 mol ∙ dm⁻³.
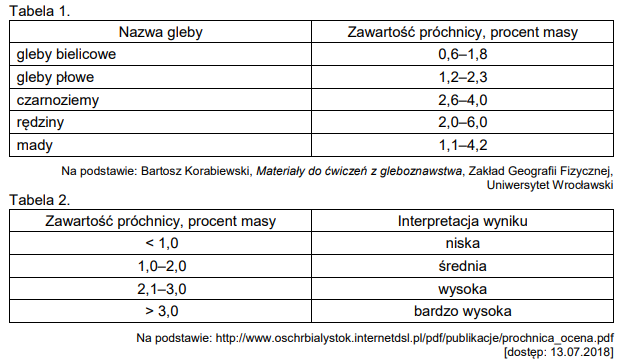
Na podstawie obliczeń ustal zawartość próchnicy w badanej glebie. Zinterpretuj otrzymany wynik na podstawie kryteriów podanych w tabeli 2.
2. Do przygotowania roztworu soli żelaza(II) najczęściej stosuje się tzw. sól Mohra o wzorze (NH₄)2SO₄·FeSO₄·6H2O.
Oblicz masę próbki soli Mohra, którą trzeba odważyć, żeby w kolbie miarowej o pojemności 100 cm³ przygotować roztwór o stężeniu jonów Fe²⁺ równym 0,1 mol ∙ dm⁻³.
3. Przed rozpoczęciem miareczkowania wprowadza się do kolby kilka kropel wodnego roztworu wskaźnika, którym jest o-fenantrolina (1,10-fenantrolina) przedstawiona wzorem 1. Sam ten
wskaźnik jest bezbarwny, ale tworzy z jonami żelaza Fe2+ kompleks (wzór 2.) o intensywnej
czerwonej barwie.
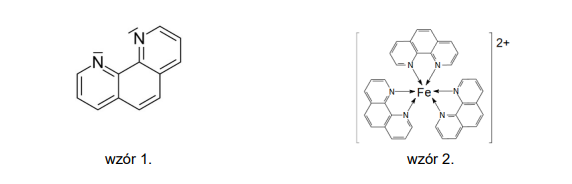
a) Wyjaśnij na podstawie struktury o-fenantroliny, dlaczego może ona, podobnie jak amoniak, pełnić funkcję ligandu w jonie kompleksowym.
b) Przyporządkuj kolby z roztworami (I–III) do kolejnych etapów miareczkowania jonów dichromianowych(VI) jonami żelaza(II) w obecności o-fenantroliny. Odpowiedź uzasadnij.

Przed rozpoczęciem miareczkowania – kolba nr ?
Uzasadnienie:
Podczas dodawania roztworu soli żelaza(II) – kolba nr ?
Uzasadnienie:
W punkcie końcowym miareczkowania – kolba nr ?
Uzasadnienie:

KOREPETYCJE