Metoda kolorymetryczna – jedna z szybszych doświadczalnych metod oznaczania orientacyjnej wartości pH roztworu
INFORMATOR o egzaminie maturalnym z chemii 22/23
Wróć do listyAzotki to grupa związków chemicznych o zróżnicowanej budowie i właściwościach, w której atomom azotu przypisuje się stopień utlenienia równy –III. Niżej opisano wybrane właściwości
dwóch azotków.
1) Azotek litu, Li3N, w temperaturze T = 298 K i pod ciśnieniem p = 1000 hPa jest krystalicznym ciałem stałym, o wysokiej temperaturze topnienia. Po stopieniu azotek litu przewodzi prąd elektryczny. Azotek litu otrzymuje się w reakcji syntezy z pierwiastków. Jest substancją higroskopijną, a w kontakcie z wodą rozkłada się z wydzieleniem amoniaku. Roztwór po reakcji azotku litu z wodą i usunięciu amoniaku z roztworu ma pH > 7. Li3N reaguje też z wodnymi roztworami kwasów.
2) Azotek boru, BN, to w temperaturze T = 298 K i pod ciśnieniem p = 1000 hPa krystaliczne, bezbarwne ciało stałe, o bardzo wysokiej temperaturze topnienia, występujące w kilku odmianach polimorficznych. Stopiony azotek boru nie przewodzi prądu elektrycznego. Zależnie od rodzaju odmiany polimorficznej wykazuje zróżnicowaną twardość od twardości zbliżonej do twardości grafitu aż do twardości diamentu. Otrzymuje się go wieloma metodami, a jedną z nich jest reakcja mocznika, CO(NH2)2, z tlenkiem boru, B2O3, w temperaturze 1000 °C, przy czym produktami ubocznymi są para wodna i tlenek węgla(IV).
1. Uzupełnij poniższe zdanie. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Azotek litu tworzy kryształy (jonowe / kowalencyjne / metaliczne), a azotek boru tworzy kryształy (jonowe / kowalencyjne / metaliczne).
2. Napisz równanie syntezy azotku litu z pierwiastków i równanie reakcji otrzymywania azotku boru z mocznika i tlenku boru.
Równanie syntezy azotku litu:
Równanie reakcji otrzymywania azotku boru:
3. Po wprowadzeniu do wody próbki Li3N o masie 43,75 mg zaszła reakcja dana równaniem:
Li3N (s) + 3H2O (c) → 3LiOH (aq) + NH3 (g)
Powstały roztwór ogrzewano aż do całkowitego usunięcia wydzielającego się w reakcji gazu. Po wystudzeniu do temperatury 25 °C mieszaninę uzupełniono wodą do końcowej objętości
750 cm3 i uzyskano bezbarwny, klarowny roztwór o gęstości 1,002 g∙cm–3 , który oznaczono symbolem S. Ustalono, że wartość pH roztworu S wynosi 11,7.
a) Na podstawie obliczeń wykaż, że pH otrzymanego roztworu S było równe 11,7.
b) Metoda kolorymetryczna to jedna z szybszych doświadczalnych metod oznaczania orientacyjnej wartości pH roztworu. Polega na użyciu kilku wskaźników do wyznaczenia przedziału, w którym zawiera się wartość pH badanego roztworu. Pobrano trzy jednakowe próbki roztworu S do trzech probówek i wprowadzono do każdej z nich z osobna po kilka kropli roztworów wskaźników I, II i III.
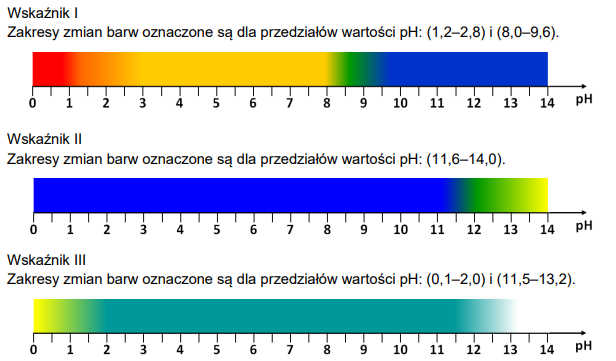
Napisz, w jakim przedziale mieści się wartość pH roztworu S wyznaczona metodą kolorymetryczną.
Wartość pH badanego roztworu wyznaczona na podstawie barw wybranych wskaźników jest większa niż i mniejsza niż .

KOREPETYCJE