Sztuczne przemiany jądrowe litu i chloru.
Arkusz maturalny z chemii rozszerzonej czerwiec 2019 nowa formuła
Wróć do listyWśród sztucznych przemian jądrowych można wyróżnić reakcje, które są następstwem bombardowania stabilnych jąder nukleonami. Poniżej przedstawiono równanie takiej reakcji (przemiana I), a drugą – opisano schematem (przemiana II).

W równaniach tych przemian bilansuje się oddzielnie liczby atomowe i oddzielnie liczby masowe. Ich sumy po obu stronach równania muszą być sobie równe.
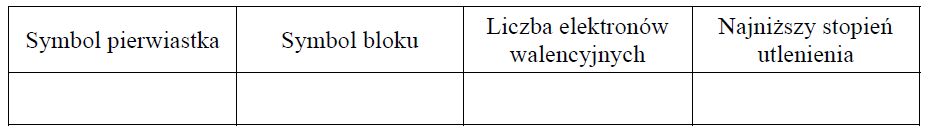
Uzupełnij poniższą tabelę – wpisz symbol chemiczny pierwiastka X, symbol bloku konfiguracyjnego, do którego należy pierwiastek X, liczbę elektronów walencyjnych w atomie pierwiastka X oraz najniższy stopień utlenienia, który przyjmuje ten pierwiastek w związkach chemicznych.
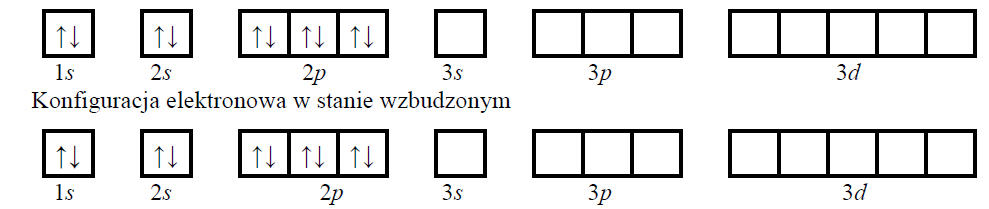
Elektrony w atomie mogą absorbować energię i zajmować wyższe poziomy energetyczne. Atom może znaleźć się wtedy w takim stanie wzbudzonym, w którym wszystkie elektrony podpowłok walencyjnych będą niesparowane.
Uzupełnij poniższe schematy, tak aby przedstawiały zapis konfiguracji elektronowej atomu pierwiastka X w stanie podstawowym oraz w stanie wzbudzonym, w którym wszystkie elektrony walencyjne są niesparowane i należą do powłoki trzeciej.
Konfiguracja elektronowa w stanie podstawowym
Oblicz, ile miligramów obu izotopów helu powstałoby łącznie ze 100 miligramów izotopu litu
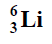
w wyniku przemiany I, gdyby proces przebiegał z wydajnością równą 100%.
Przyjmij, że wartości masy atomowej poszczególnych izotopów są równe ich liczbom masowym.
KOREPETYCJE