Sól Mohra – wygodne i stabilne źródło jonów żelaza(II)
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MARZEC 2022
Wróć do listySól Mohra to zwyczajowa nazwa siarczanu(VI) żelaza(II) i amonu o wzorze (NH4)2Fe(SO4)2. W laboratorium chemicznym ten związek jest często używany jako wygodne i stabilne źródło jonów żelaza(II). Zarówno sama sól Mohra, jak i jej wodne roztwory są odporne na utlenianie na powietrzu.
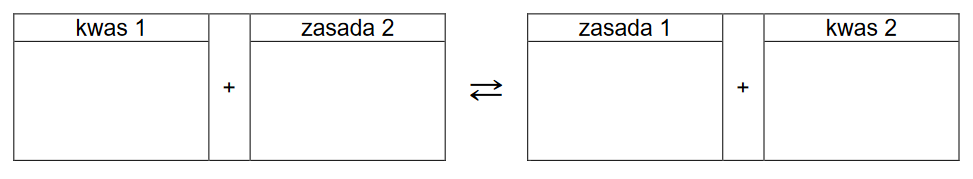
1. Obecność jonów amonowych w roztworze soli Mohra powoduje, że odczyn tego roztworu nie jest obojętny.
Napisz równanie reakcji odpowiadającej za odczyn wodnego roztworu soli Mohra na podstawie definicji kwasów i zasad Brønsteda. Wzory odpowiednich drobin wpisz w poniższą tabelę.
2. Przeprowadzono dwuetapowe doświadczenie. W pierwszym etapie do dwóch probówek (A i B) z roztworem soli Mohra dodano wodny roztwór wodorotlenku sodu. Wynik doświadczenia w obu probówkach był identyczny i został przedstawiony na fotografii.

W czasie doświadczenia zaszła reakcja chemiczna opisana równaniem:
Fe2+ + 2OH– → Fe(OH)2
Zaobserwowano również, że zwilżony uniwersalny papierek wskaźnikowy umieszczony u wylotu probówki zabarwił się na niebiesko.
Napisz w formie jonowej skróconej równanie reakcji zachodzącej po dodaniu wodnego roztworu wodorotlenku sodu, w wyniku której powstała substancja odpowiedzialna za zmianę barwy uniwersalnego papierka wskaźnikowego.
3. W drugim etapie doświadczenia do zawartości probówki A otrzymanej w poprzednim etapie dodano wodę utlenioną, czyli roztwór nadtlenku wodoru o stężeniu 3 %. Wynik tej części doświadczenia przedstawiono na fotografii.

Napisz w formie cząsteczkowej równanie reakcji zachodzącej w probówce A.
4. Probówkę B pozostawiono przez dłuższy czas na powietrzu. W probówce zaobserwowano zmiany, które zilustrowano na poniższych fotografiach.
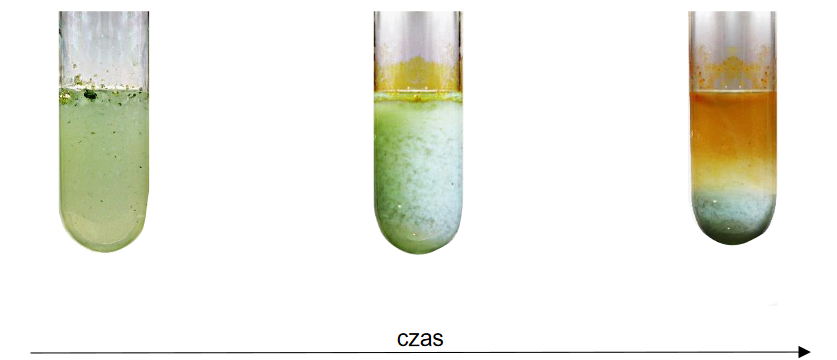
Wyjaśnij przyczyny obserwowanych zmian w probówce B pomimo niedodania do tej probówki żadnego odczynnika.
Wyjaśnienie:

KOREPETYCJE