definicja kwasu i zasady Brønsteda
Arkusz z chemii rozszerzonej czerwiec 2023 stara formuła
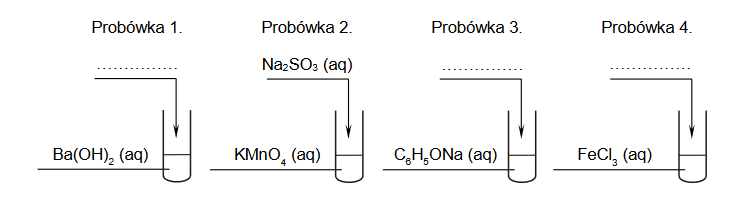
Wróć do listyDo probówek oznaczonych numerami 1.–4. wprowadzono wodne roztwory czterech substancji chemicznych: wodorotlenku baru, manganianu(VII) potasu, fenolanu sodu i chlorku żelaza(III). Stężenie molowe każdego roztworu wynosiło 0,10 mol * dm_3.
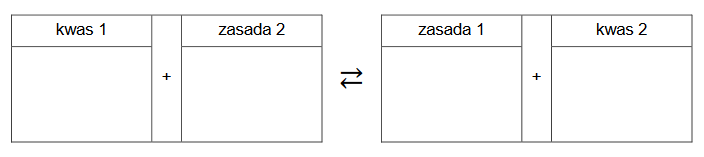
1. Wpisz do schematu wzory odpowiednich drobin, tak aby powstało równanie procesu decydującego o odczynie roztworu fenolanu sodu. Zastosuj definicję kwasu i zasady Brønsteda.
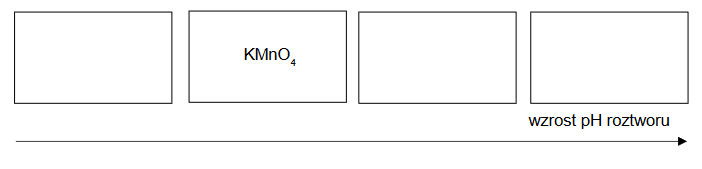
2. Uporządkuj roztwory znajdujące się w probówkach według wzrastającego pH. Uzupełnij poniższy schemat. Wpisz w wolne pola wzory substancji znajdujących się w roztworach
3. Roztwory z probówek 1.–4. posłużyły do przeprowadzenia doświadczenia. Do jednej z probówek wprowadzono tlenek węgla(IV), a do pozostałych dodano pojedynczo odczynniki: NaOH (aq), Na2SO3 (aq) oraz HCl (aq). Każdego z roztworów użyto jeden raz. Po wymieszaniu zawartości probówek w każdej z nich zaobserwowano zmętnienie lub wytrącenie osadu.
3.1
Ustal, do której probówki został wprowadzony tlenek węgla(IV), a do których – wodne roztwory: NaOH oraz HCl. Uzupełnij podane niżej schematy.
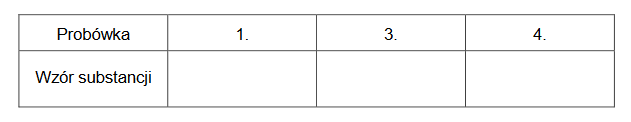
2. Wpisz do tabeli wzory substancji, których powstanie w probówkach 1., 3. oraz 4. odpowiadało za opisany objaw reakcji.
3. W probówce 2., po zmieszaniu reagentów, zachodzi proces utleniania-redukcji. Utleniacz i reduktor reagują ze sobą w stosunku molowym 2 : 3, a trzecim substratem reakcji jest woda.
Napisz w formie jonowej skróconej równanie tej reakcji.

KOREPETYCJE