Zadanie 35.
2015 zbiór CKE
Wróć do listyNa rysunkach przedstawiono przestrzenne rozmieszczenie wiązań chemicznych tworzonych przez orbitale zhybrydyzowane atomów węgla w cząsteczkach dwóch węglowodorów. Punktami schematycznie oznaczono położenie środków atomów połączonych tymi wiązaniami, linią ciągłą – osie wiązań, a linią przerywaną – kontury figury geometrycznej, w której narożach znajdują się atomy otaczające atom centralny. Hybrydyzacja polegająca na wymieszaniu 1 orbitalu s oraz 3 orbitali p daje hybrydyzację tetraedryczną ze względu na skierowanie orbitali zhybrydyzowanych ku narożom tetraedru. Wymieszanie 1 orbitalu s oraz 2 orbitali p daje hybrydyzację trygonalną. Wiązania utworzone za pomocą tych orbitali leżą w tej samej płaszczyźnie, a kąty pomiędzy nimi wynoszą 120°.
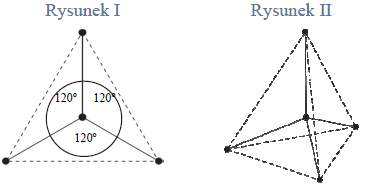
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2011, s. 151, 152, 155, 156.
a) Spośród odczynników wymienionych poniżej wybierz wszystkie te, które pozwolą na odróżnienie węglowodoru o strukturze przestrzennej przedstawionej na rysunku I od węglowodoru o strukturze przedstawionej na rysunku II.
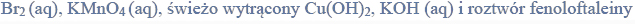
b) Napisz, jakie zmiany możliwe do zaobserwowania podczas reakcji każdego wybranego odczynnika z węglowodorami o strukturach przedstawionych na rysunkach I i II, pozwalają na odróżnienie tych węglowodorów.
c) Uzasadnij swój wybór odczynników, pisząc odpowiednie równania reakcji.
KOREPETYCJE