blok S P D
Arkusz maturalny z chemii rozszerzonej lipiec 2020 Formuła 2015
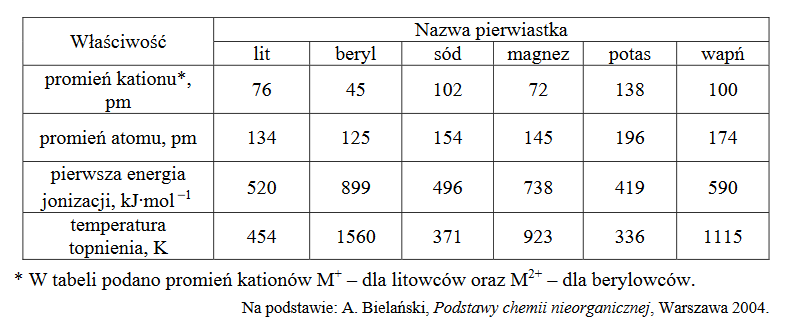
Wróć do listyW poniższej tabeli zestawiono wybrane właściwości litowców i berylowców.
1. Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
1. Dla pierwiastków danego okresu stosunek promienia jonowego do promienia atomowego litowca jest (większy / mniejszy) niż stosunek promienia jonowego do promienia atomowego berylowca.
2. W każdym okresie temperatury topnienia berylowców są (wyższe / niższe) niż temperatury topnienia litowców, czego przyczyną jest silniejsze wiązanie metaliczne występujące między atomami (berylowców / litowców).
2. Pierwsza energia jonizacji to minimalna energia potrzebna do oderwania jednego elektronu od atomu pierwiastka w stanie gazowym, czego skutkiem jest powstanie kationu. Molowa energia jonizacji – wyrażona w kJ∙mol 1− – jest równa energii jonizacji 1 mola atomów.
Sformułuj zależność między wartością pierwszej energii jonizacji a liczbą atomową berylowca. Wyjaśnij, dlaczego pierwsza energia jonizacji litowca jest niższa niż pierwsza energia jonizacji berylowca leżącego w tym samym okresie układu okresowego.
Zależność między pierwszą energią jonizacji a liczbą atomową berylowca:
Pierwsza energia jonizacji litowca jest niższa niż pierwsza energia jonizacji berylowca, leżącego w tym samym okresie układu okresowego pierwiastków, ponieważ

KOREPETYCJE