miareczkowanie potencjometryczne – jedna z metod potencjometrycznych
INFORMATOR o egzaminie maturalnym z chemii 22/23
Wróć do listyW analizie potencjometrycznej wykorzystuje się zależność potencjału odpowiednich elektrod od stężenia jonów oznaczanych. Pomiary potencjometryczne polegają na mierzeniu SEM ogniwa zestawionego z dwóch półogniw: tzw. elektrody wskaźnikowej, zanurzonej w badanym roztworze, oraz tzw. elektrody odniesienia, zanurzonej w roztworze o niezmiennym składzie, której potencjał w warunkach pomiaru pozostaje stały.
Rozróżnia się dwa główne typy elektrod. Elektrody pierwszego rodzaju to elektrody odwracalne względem kationu: są zbudowane z metalu i są w równowadze z roztworem zawierającym jony tego metalu (M oznacza symbol metalu):
M(s) + ⇄ Mⁿ⁺(aq) + 𝑛e⁻
Elektrody drugiego rodzaju są odwracalne względem anionu, tworzącego z metalem elektrody trudno rozpuszczalny związek. Elektrodą drugiego rodzaju jest elektroda halogenosrebrowa. Działanie tej elektrody opisuje równanie (X oznacza symbol halogenu):
AgX(s) + e– ⇄ Ag(s) + X⁻(aq)
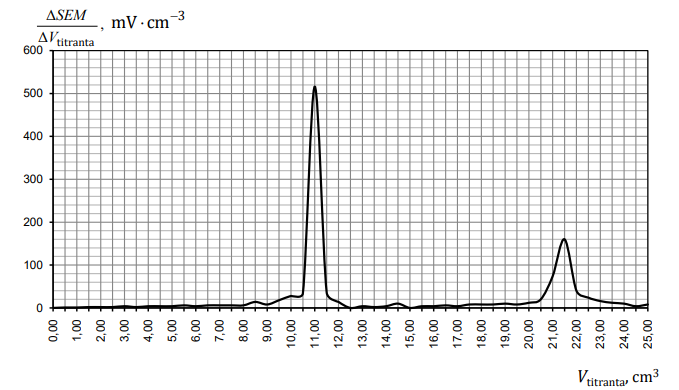
1. Jedną z metod potencjometrycznych jest miareczkowanie potencjometryczne. Przeprowadzono miareczkowanie potencjometryczne w celu oznaczenia stężenia anionów chlorkowych i jodkowych w badanym roztworze. Próbkę roztworu o objętości V0 = 10,00 cm³ rozcieńczono wodą do objętości 50,00 cm³ . Ten rozcieńczony roztwór stanowił analit. Z elektrody srebrowej jako elektrody wskaźnikowej oraz elektrody halogenosrebrowej jako elektrody odniesienia zbudowano ogniwo, po czym zmierzono jego SEM. Następnie do analitu stopniowo wkraplano roztwór azotanu(V) srebra o stężeniu c AgNO₃ = 0,05 mol dm⁻³ . Po dodaniu każdej porcji titranta mierzono SEM ogniwa. W czasie miareczkowania wytrącały się kolejno osady halogenków srebra, czemu towarzyszyły dwie duże zmiany mierzonej siły elektromotorycznej odpowiadające dwóm
punktom równoważnikowym miareczkowania. Punkt równoważnikowy I odpowiadał momentowi, w którym liczba dodanych moli jonów Ag⁺ była równa liczbie moli jonów halogenkowych wytrącających się jako pierwsze. Analogicznie przebiegało oznaczenie drugiego rodzaju jonów halogenkowych i momentowi, w którym zaszła równość liczb moli, odpowiadał punkt równoważnikowy II.
Aby wyznaczyć objętość titranta w I i II punkcie równoważnikowym miareczkowania, dla każdej dodanej porcji titranta ΔVtitranta obliczono zmianę siły elektromotorycznej ogniwa ΔSEM, a następnie sporządzono wykres
V jako funkcji Vtitranta.

jako funkcji Vtitranta
W temperaturze 298 K iloczyn rozpuszczalności chlorku srebra
Kso[AgCl] 1,6 ⋅ 10⁻¹⁰ , a jodku srebra Kso[AgI] 1,5 ⋅ 10 ⁻¹⁶.
1. Oblicz stężenie molowe jonów chlorkowych w roztworze, którego próbkę o objętości V0 = 10,00 cm³ pobrano do miareczkowania.
2. Przykładem elektrody halogenosrebrowej jest elektroda chlorosrebrowa:
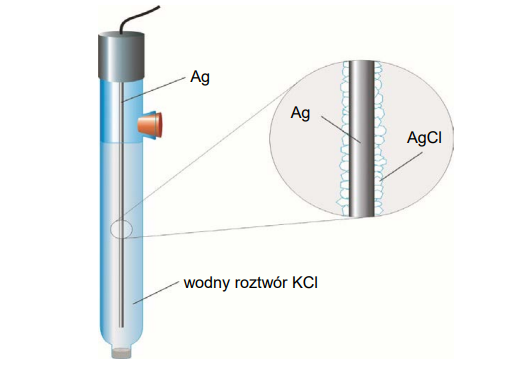
Działanie elektrody chlorosrebrowej opisuje równanie:
AgCl(s) + e⁻ ⇄ Ag(s) + Cl⁻ (aq)
Potencjał tej elektrody zależy od stężenia jonów chlorkowych w roztworze, który stanowi jej element, i wyraża się równaniem: o E Ag/AgCl = E° Ag/AgCl -0,059log Cl- (w temperaturze 298 K).
Przygotowano dwie elektrody chlorosrebrowe: elektroda I zawierała wodny roztwór chlorku potasu o stężeniu równym 0,10 mol ∙dm⁻³, a elektroda II – wodny roztwór tej samej soli o stężeniu równym 0,01 mol ∙dm⁻³
Rozstrzygnij, która elektroda chlorosrebrowa (I czy II) ma – w tej samej temperaturze – wyższy potencjał. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
3. Jako elektroda odniesienia w opisanym miareczkowaniu potencjometrycznym może być zastosowana tzw. nasycona elektroda kalomelowa.

Schemat tej elektrody przedstawiono poniżej:
Hg │ Hg₂Cl₂ (s), KCl (roztwór nasycony)
Zasada działania tej elektrody jest taka sama jak elektrody chlorosrebrowej.
Napisz równanie reakcji elektrodowej zachodzącej w elektrodzie kalomelowej

KOREPETYCJE