Sekwencja aminokwasów w peptydach – analiza składu
EGZAMIN MATURALNY Z CHEMII POZIOM ROZSZERZONY MAJ 2022
Wróć do listySekwencję aminokwasów w peptydach przedstawia się najczęściej za pomocą trzyliterowych kodów aminokwasów. W tej notacji z lewej strony umieszcza się kod aminokwasu, którego reszta zawiera wolną grupę aminową połączoną z atomem węgla α (tzw. N–koniec). Analiza składu pewnego pentapeptydu wykazuje, że powstał on z pięciu różnych aminokwasów. Cztery z aminokwasów, które zidentyfikowano podczas analizy, to: Gly, Cys, Phe, Leu. Piąty aminokwas, którego nie udało się zidentyfikować, oznaczono jako Xxx. Ustalono ponadto, że ten aminokwas stanowi N–koniec peptydu.
Podczas częściowej hydrolizy badanego pentapeptydu otrzymano następujące peptydy:
Cys–Leu–Phe Gly–Cys–Leu Xxx–Gly Leu–Phe
1. Napisz sekwencję aminokwasów analizowanego pentapeptydu. Zastosuj oznaczenie Xxx niezidentyfikowanego aminokwasu.
2. W celu zidentyfikowania aminokwasu Xxx przeprowadzono reakcję peptydu z izotiocyjanianem fenylu o wzorze C6H5NCS. Ten związek reaguje wyłącznie z N–końcowym aminokwasem peptydu, a w wyniku kolejnych przemian otrzymuje się pochodną fenylotiohydantoiny oraz peptyd o łańcuchu krótszym o jedną resztę aminokwasową. Poniżej przedstawiono schemat tego procesu.
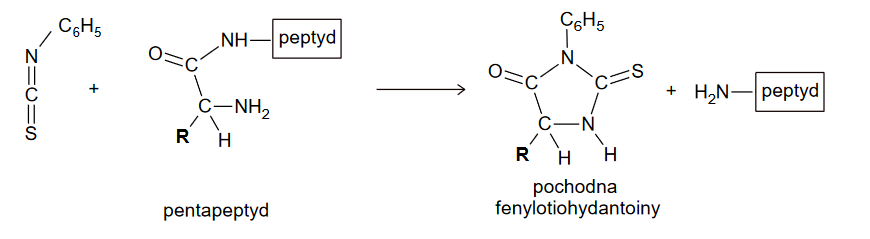
We wzorze pochodnej fenylotiohydantoiny grupa R oznacza łańcuch boczny N–końcowego aminokwasu analizowanego peptydu.
Badany pentapeptyd poddano opisanemu procesowi i ustalono, że uzyskana pochodna fenylotiohydantoiny ma masę molową równą 206 g * mol–1.
Oblicz masę molową grupy R aminokwasu Xxx oraz zidentyfikuj badany aminokwas – napisz trzyliterowy kod tego aminokwasu.

KOREPETYCJE