Hydroliza anionowa roztworu węglanu.
Arkusz maturalny z chemii rozszerzonej maj 2017 nowa formuła
Wróć do listyWęglany w roztworach wodnych ulegają hydrolizie anionowej, która polega na dysocjacji zasadowej anionu, zgodnie z równaniem:
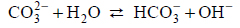
Drugi etap hydrolizy polegający na reakcji jonu
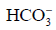
z wodą zachodzi w tak małym stopniu, że nie ma wpływu na pH roztworu.
W temperaturze 25 °C wodny roztwór węglanu potasu o stężeniu
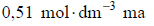
ma pH równe 12,0.
Oblicz stałą dysocjacji zasadowej (stałą równowagi reakcji hydrolizy) anionu węglanowego. Uwzględnij fakt, że w wyrażeniu na stałą dysocjacji zasadowej anionu węglanowego pomija się stężenie wody.
KOREPETYCJE